安科生物1类创新药AK2024注射液临床试验获批
发布日期:2025-07-02 浏览次数:2673
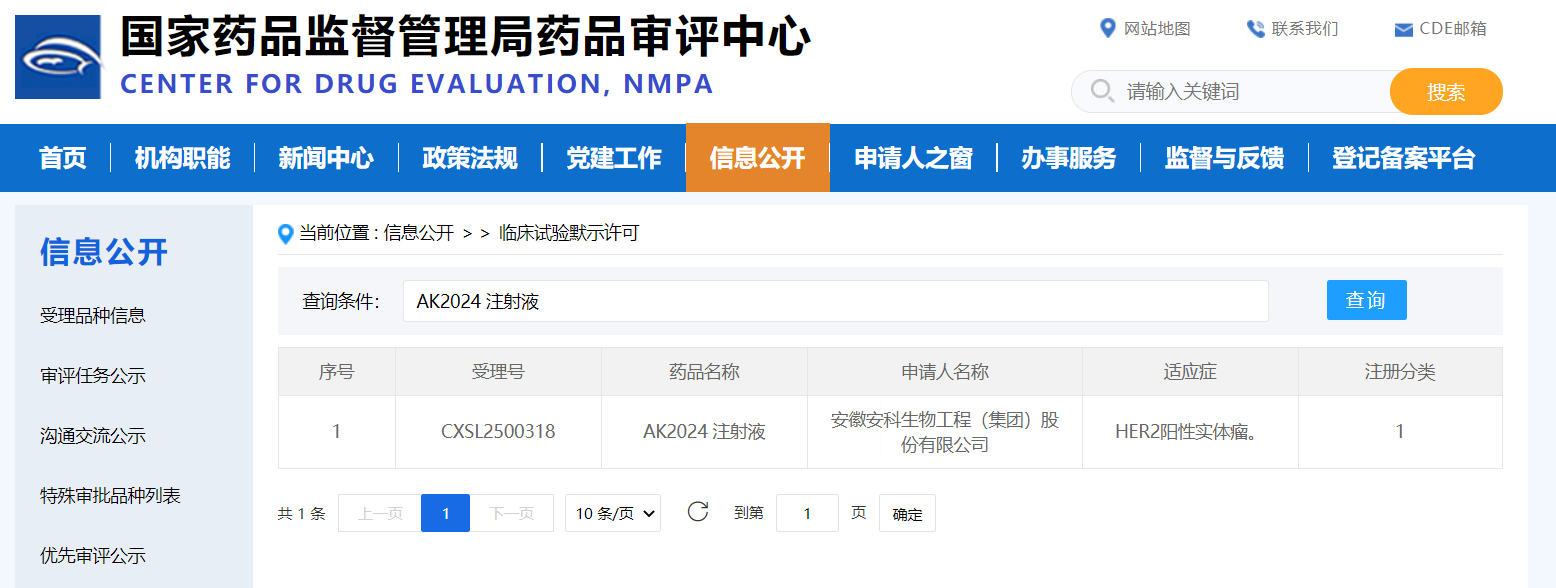
近日,安徽安科生物工程(集团)股份有限公司自主研发的1类创新药—AK2024注射液获得国家药品监督管理局(NMPA)核准签发的《药物临床试验批准通知书》。标志着该产品获准在中国开展用于HER2阳性晚期实体瘤的临床试验,这也是该药物在全球范围内首次获批进入临床研究阶段。
AK2024注射液是安科生物创新研发管线的重要成果,注册分类为治疗用生物制品1类。作为一款创新型抗HER2单克隆抗体药物,AK2024注射液采用以曲妥珠单抗为基础的功能检测方法筛选获得。其独特之处在于选择性作用于人表皮生长因子受体-2(HER2)的细胞外特定结构域,其抗原识别表位区别于现有曲妥珠单抗及帕妥珠单抗的结合位点。AK2024注射液的作用机制包括阻断HER2同源二聚体的组成性激活、干扰HER2与其他ErbB2家族成员形成异源二聚体,并阻断下游信号通路,从而抑制肿瘤细胞的增殖。

人表皮生长因子受体-2(HER2)的过表达或扩增与多种恶性肿瘤(如乳腺癌、胃癌等)的发生发展密切相关,针对该靶点的治疗始终是临床研究的重点领域。临床前研究数据表明,AK2024注射液与肿瘤细胞表面的HER2具有高亲和力和强结合活性,能有效抑制HER2阳性肿瘤细胞的增殖。值得关注的是,非临床药效学研究证实,AK2024注射液与曲妥珠单抗联用展现出显著的协同抗肿瘤效果,在增强曲妥珠单抗对肿瘤生长抑制作用方面,其协同效应显著优于帕妥珠单抗,为拓展HER2阳性肿瘤的联合治疗方案提供了新的可能性。
AK2024注射液独特的分子设计,有望为HER2阳性肿瘤患者带来新的治疗选择。公司将严格按照国家相关法规要求,积极、有序地推进该药物的临床研究进程,力争早日惠及广大患者。

近日,安徽安科生物工程(集团)股份有限公司自主研发的1类创新药—AK2024注射液获得国家药品监督管理局(NMPA)核准签发的《药物临床试验批准通知书》。标志着该产品获准在中国开展用于HER2阳性晚期实体瘤的临床试验,这也是该药物在全球范围内首次获批进入临床研究阶段。
AK2024注射液是安科生物创新研发管线的重要成果,注册分类为治疗用生物制品1类。作为一款创新型抗HER2单克隆抗体药物,AK2024注射液采用以曲妥珠单抗为基础的功能检测方法筛选获得。其独特之处在于选择性作用于人表皮生长因子受体-2(HER2)的细胞外特定结构域,其抗原识别表位区别于现有曲妥珠单抗及帕妥珠单抗的结合位点。AK2024注射液的作用机制包括阻断HER2同源二聚体的组成性激活、干扰HER2与其他ErbB2家族成员形成异源二聚体,并阻断下游信号通路,从而抑制肿瘤细胞的增殖。

人表皮生长因子受体-2(HER2)的过表达或扩增与多种恶性肿瘤(如乳腺癌、胃癌等)的发生发展密切相关,针对该靶点的治疗始终是临床研究的重点领域。临床前研究数据表明,AK2024注射液与肿瘤细胞表面的HER2具有高亲和力和强结合活性,能有效抑制HER2阳性肿瘤细胞的增殖。值得关注的是,非临床药效学研究证实,AK2024注射液与曲妥珠单抗联用展现出显著的协同抗肿瘤效果,在增强曲妥珠单抗对肿瘤生长抑制作用方面,其协同效应显著优于帕妥珠单抗,为拓展HER2阳性肿瘤的联合治疗方案提供了新的可能性。
AK2024注射液独特的分子设计,有望为HER2阳性肿瘤患者带来新的治疗选择。公司将严格按照国家相关法规要求,积极、有序地推进该药物的临床研究进程,力争早日惠及广大患者。
















